Valence bond (VB) teori er en kjemisk bindingsteori som forklarer det kjemiske liming mellom to atomer. I likhet med molekylær orbital (MO) teori forklarer den binding ved bruk av kvantemekanikkens prinsipper. I følge valensbindingsteorien er binding forårsaket av overlappingen av halvfylt atom orbitaler. De to atomene del hverandres uparede elektron for å danne en fylt orbital for å danne en hybrid bane og bind sammen. Sigma og pi-obligasjoner er en del av valensbindingsteorien.
Key Takeaways: Valence Bond (VB) Theory
- Valence bond theory eller VB theory er en teori basert på kvantemekanikk som forklarer hvordan kjemisk binding fungerer.
- I valensbindingsteori kombineres atomatomene i individuelle atomer for å danne kjemiske bindinger.
- Den andre hovedteorien om kjemisk binding er molekylær orbital teori eller MO teori.
- Valensbindingsteori brukes for å forklare hvordan kovalente kjemiske bindinger dannes mellom flere molekyler.
Teori
Valensbindingsteori forutsier kovalent bindingsdannelse mellom atomer når de har halvfylte valens-atombaner, som hver inneholder et enkelt uparret elektron. Disse atomomløpene overlapper hverandre, så elektroner har størst sannsynlighet for å være innenfor bindingsområdet. Begge atomer deler deretter de enkelt uparede elektronene for å danne svakt koblede orbitaler.
De to atomiske orbitalene trenger ikke å være de samme som hverandre. For eksempel kan sigma- og pi-obligasjoner overlappe hverandre. Sigma-bindinger dannes når de to delte elektronene har orbitaler som overlapper hverandre. I kontrast dannes pi-bindinger når orbitalene overlapper hverandre, men er parallelle med hverandre.
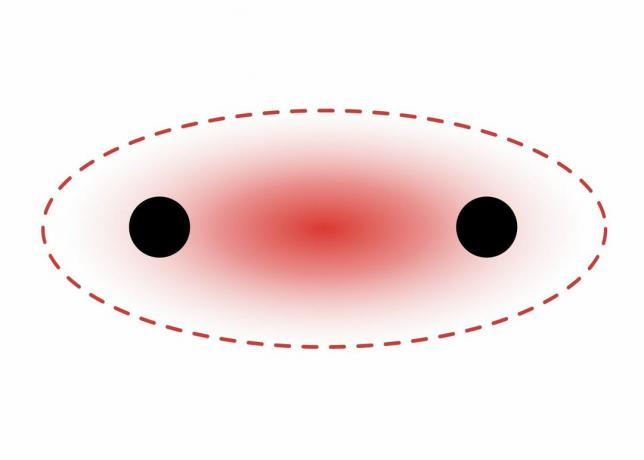
Sigma-bindinger dannes mellom elektroner fra to s-orbitaler fordi banebanen er sfærisk. Enkeltobligasjoner inneholder en sigmaobligasjon. Dobbeltbindinger inneholder en sigma-obligasjon og en pi-obligasjon. Trippel obligasjoner inneholder en sigma obligasjon og to pi obligasjoner. Når det dannes kjemiske bindinger mellom atomer, kan atomomgangene være hybrider av sigma- og pi-bindinger.
Teorien er med på å forklare bindingsdannelse i tilfeller der a Lewis-struktur kan ikke beskrive ekte oppførsel. I dette tilfellet kan flere valensbindingstrukturer brukes for å beskrive en enkelt Lewis-strengering.
Historie
Valensbindingsteori henter fra Lewis-strukturer. G.N. Lewis foreslo disse strukturene i 1916, basert på ideen om at to delte bindingselektroner dannet kjemiske bindinger. Kvantemekanikk ble brukt for å beskrive bindingsegenskaper i Heitler-London-teorien fra 1927. Denne teorien beskrev kjemisk bindingsdannelse mellom hydrogenatomer i H2-molekylet ved å bruke Schrödingers bølgeforligning for å slå sammen bølgefunksjonene til de to hydrogenatomene. I 1928 kombinerte Linus Pauling Lewis 'parbindingsidee med Heitler-London teorien for å foreslå valensbindingsteori. Valensbindingsteori ble utviklet for å beskrive resonans og omløpshybridisering. I 1931 publiserte Pauling et papir om valensbindingsteori med tittelen "On the Nature of the Chemical Bond." De første dataprogrammene som ble brukt for å beskrive kjemisk binding brukt molekylær orbital teori, men siden 1980-tallet har prinsipper for valensbindingsteori blitt programmerbar. I dag er de moderne versjonene av disse teoriene konkurransedyktige med hverandre når det gjelder å beskrive ekte atferd nøyaktig.
Bruker
Valensbindingsteori kan ofte forklare hvordan kovalente bindinger danne. De diatomic fluormolekyl, F2, er et eksempel. Fluoratomer danner enkelt kovalente bindinger med hverandre. F-F-bindingen er resultat av overlapp pz orbitaler, som hver inneholder et enkelt uparret elektron. En lignende situasjon forekommer i hydrogen, H2, men bindingslengder og styrke er forskjellige mellom H2 og F2 molekyler. Det dannes en kovalent binding mellom hydrogen og fluor i hydrofluorsyre, HF. Denne bindingen dannes fra overlappingen av hydrogenet 1s orbital og fluor 2pz orbital, som hver har et uparret elektron. I HF deler både hydrogen og fluoratomer disse elektronene i en kovalent binding.
kilder
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "Den elektroniske strukturen til benzenmolekylet." Natur. 323 (6090): 699. gjør jeg:10,1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "Den elektroniske strukturen til benzenmolekylet." Natur. 329 (6139): 492. gjør jeg:10,1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedder, J.M. (1985). Den kjemiske bindingen (2. utg.). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Elektronisk struktur av benzenmolekylet." Natur. 325 (6103): 396. gjør jeg:10,1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). A Chemist's Guide to Valence Bond Theory. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.