phosphorescence er luminescens som oppstår når energi er levert av elektromagnetisk stråling, vanligvis ultrafiolett lys. Energikilden sparker et elektron av en atom fra en lavere energitilstand til en "opphisset" høyere energitilstand; så frigjør elektronet energien i form av synlig lys (luminescens) når den faller tilbake til en lavere energitilstand.
Viktige takeaways: fosforesens
- Fosforescens er en type fotoluminescens.
- Ved fosforescens blir lyset absorbert av et materiale som støter opp energinivået til elektroner i en spent tilstand. Lysets energi stemmer imidlertid ikke helt overens med energien i tillatte spente tilstander, slik at de absorberte bildene blir sittende fast i en triplet tilstand. Overganger til en lavere og mer stabil energitilstand tar tid, men når de oppstår frigjøres lys. Fordi denne frigjøringen skjer sakte, ser det ut som et fosforescerende materiale gløder i mørket.
- Eksempler på fosforescerende materialer inkluderer glød-i-mørke stjerner, noen sikkerhetstegn og glødende maling. I motsetning til fosforescerende produkter, slutter lysrørpigmenter å gløde når lyskilden er fjernet.
- Selv om den er oppkalt etter den grønne gløden til elementet fosfor, gløder fosfor faktisk på grunn av oksidasjon. Det er ikke fosforescerende!
Enkel forklaring
Fosforescens frigjør den lagrede energien sakte over tid. I utgangspunktet "fosforescerende materiale" lades "ved å utsette det for lys. Deretter lagres energien i en periode og frigjøres sakte. Når energien frigjøres umiddelbart etter å ha absorbert den innfallende energien, kalles prosessen fluorescens.
Kvantemekanikk Forklaring
Ved fluorescens absorberer og avgir en overflate et foton nesten umiddelbart (ca. 10 nanosekunder). Fotoluminescens er rask fordi energien til de absorberte fotonene samsvarer med energitilstander og tillatte overganger av materialet. Fosforescens varer mye lenger (millisekunder opp til dager) fordi det absorberte elektronet krysser til en opphisset tilstand med høyere spinnmultiplikitet. De glade elektronene blir fanget i en tripletilstand og kan bare bruke "forbudte" overganger for å slippe til en singlet-tilstand med lavere energi. Kvantemekanikk tillater forbudt overgang, men de er ikke kinetisk gunstige, så det tar lengre tid å skje. Hvis det absorberes nok lys, blir det lagrede og frigjorte lyset tilstrekkelig betydelig til at materialet ser ut til å "gløde i av denne grunn virker fosforescerende materialer, som lysstoffrør, veldig lyse under et svart (ultrafiolett) lys. Et Jablonski-diagram blir ofte brukt for å vise forskjellen mellom fluorescens og fosforesens.
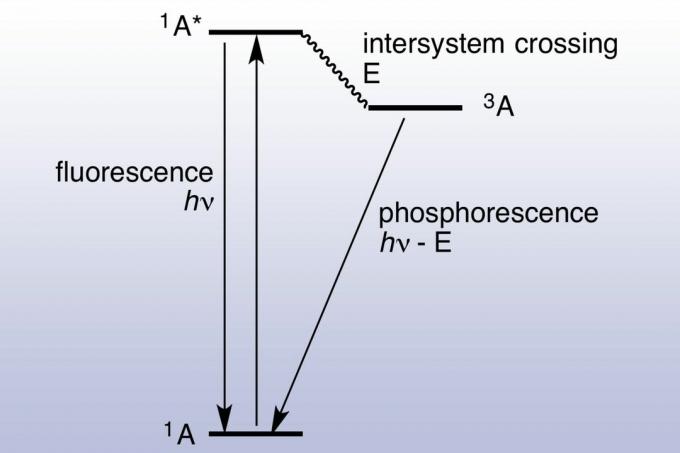
Historie
Studien av fosforescerende materialer stammer fra minst 1602 da italienske Vincenzo Casciarolo beskrev en "lapis solaris" (solstein) eller "lapis lunaris" (månestein). Funnet ble beskrevet i filosofiprofessor Giulio Cesare la Gallas bok fra 1612 De Phenomenis i Orbe Lunae. La Galla melder at Casciarolos stein sendte lys ut på den etter at den var blitt forkalket gjennom oppvarming. Den mottok lys fra solen og deretter (som månen) ga lys ut i mørket. Steinen var uren baritt, selv om andre mineraler også viser fosforescens. De inkluderer noen diamanter (kjent for den indiske kongen Bhoja så tidlig som 1010-1055, gjenoppdaget av Albertus Magnus og igjen gjenoppdaget av Robert Boyle) og hvit topas. Spesielt kineserne verdsatte en type fluoritt kalt klorofan som ville vise luminescens fra kroppsvarme, eksponering for lys eller bli gnidd. Interesse for fosforescens og andre typer luminescens førte til slutt til oppdagelsen av radioaktivitet i 1896.
materialer
Foruten noen få naturlige mineraler produseres fosforescens av kjemiske forbindelser. Sannsynligvis den mest kjente av disse er sinksulfid, som har blitt brukt i produkter siden 1930-tallet. Sinksulfid avgir vanligvis en grønn fosforesens, selv om fosfor kan tilsettes for å endre lysets farge. Fosforene absorberer lyset som avgis av fosforesens og slipper det deretter som en annen farge.
Mer nylig blir strontiumaluminat brukt for fosforesens. Denne forbindelsen gleder ti ganger lysere enn sinksulfid og lagrer også energien sin mye lenger.
Eksempler på fosforesens
Vanlige eksempler på fosforescens inkluderer stjerner som folk legger på soveromsvegger som gløder i timevis etter at lysene er slått ut og maling som brukes til å lage glødende stjernemalerier. Selv om elementet fosfor lyser grønt, lyset frigjøres fra oksidasjon (kjemiluminescens) og er ikke et eksempel på fosforescens.
kilder
- Franz, Karl A.; Kehr, Wolfgang G.; Siggel, Alfred; Wieczoreck, Jürgen; Adam, Waldemar (2002). "Selvlysende materialer" i Ullmanns leksikon for industriell kjemi. Wiley-VCH. Weinheim. doi: 10.1002 / 14356007.a15_519
- Roda, Aldo (2010). Kjemiluminescens og bioluminescens: fortid, nåtid og fremtid. Royal Society of Chemistry.
- Zitoun, D.; Bernaud, L.; Manteghetti, A. (2009). Mikrobølgesyntese av en langvarig fosfor. J. Chem. Educ. 86. 72-75. doi: 10.1021 / ed086p72